Ostatnio oglądane
Zaloguj się aby zobaczyć listę pozycji
Ulubione
Zaloguj się aby zobaczyć listę pozycji

Z mglistych rojeń alchemików średniowiecznych zaczęła powoli wyłaniać się nowa umiejętność, poświęcona nie egoistycznym dążeniom przemiany metali w złoto, lecz badaniom własności różnorodnych ciał, spotykanych w przyrodzie, w zastosowaniu do fizyologii, medycyny i farmacyi. Zerwanie z mistycznemi żywiołami starożytnych i wkroczenie na drogę doświadczeń ścisłych było najbardziej znamiennym zwrotem badaczy przyrody, chcących wywalczyć prawa samodzielności nauce, która błąkała się w labiryncie nieokreślonych dociekań, nie mając ani punktów wytycznych swej drogi, ani określonego celu. Kiedy nastąpiło to przebudzenie z drzemki długowiecznej i krytyczne rozpatrywanie dotychczasowych poglądów na ustrój przyrody – dokładnie wiadomem nie jest; wszakże już w drugiej połowie XVII stulecia Robert Boyle wygłasza śmiały pogląd, że chemicy kierują się dotychczas kruchemi zasadami, widząc swe zadanie jedynie w przyrządzaniu leków, w otrzymywaniu i przemianie metali. Chemię należy traktować z filozoficznego punktu widzenia, a wytężając swe siły ku przeprowadzeniu doświadczeń i spostrzeżeń, które pozwolą w następstwie na ugruntowanie teoryi, można wyświadczyć światu naukowemu prawdziwą przysługę.
Nowy apostoł wiedzy znalazł zwolenników nawet po za granicami swej ojczyzny; wszakże ogół przyrodników uprawiał nadal alchemię wraz z całym arsenałem średniowiecznych przesądów. Z katedr akademickich przemawiali profesorowie alchemii i astrologii, którym hołdowali nawet ludzie wielkiego talentu i wiedzy prawdziwej, jak np. von Belmont, Becher i inni. Wobec mało jeszcze zbadanych zjawisk chemicznych, a ztąd niedość ugruntowanych poglądów teoretycznych, kierunek chemii, wytknięty przez Boyla, nie utrzymał się, zwłaszcza, że twórcy innych teoryi z pomocą dowolnych uogólnień łatwiej trafiali do przekonania, objaśniali pewne zjawiska sposobem napozór nader prostym, chociaż w rzeczywistości nie wyjrzeli po za obręb ciasnych poglądów na budowę materyi filozofów starożytności. Największą wziętością cieszyła się teorya Jerzego Stahla (1660 † 1734), tłomacząca powstawanie płomienia oraz palenie się ciał. Według Stahla każde ciało palne zawiera w sobie materyę ogniową, zwaną przezeń flogistonem, która miała być składową częścią wszystkich ciał, ulegających przy wysokiej temperaturze trwałym zmianom; gdy ciało pali się-traci swój flogiston, który uchodzi przy wysokiej temperaturze i odwrotnie, gdy do produktów spalenia dodamy flogiston, powinniśmy otrzymać ciało pierwotne. Metal np., według Stahla, wydziela przy ogrzewaniu flogiston, pozostawiając „wapnou owego metalu; chcąc zaś z wapna otrzymać metal, należy dodać flogistonu.
W czasach, gdy nie był znany tlen, a zatem gdy nie była wyjaśnioną jeszcze znaczna ilość zjawisk chemicznych, polegająca na utlenianiu, hypoteza Stahla znalazła wielu stronników, kontentujących się widocznie jakim takim systematem, tembardziej, że twórca tej hypotezy, jako długoletni profesor berliński, umiał swą powagą uczonego zjednać sobie wśród licznych słuchaczy tylu zwolenników, rozwijających jego poglądy, że jeszcze w drugiej połowie XVIII stulecia, gdy badania Lavoisier’a zaczęły poważnie podkopywać teoryę Stahla, flogiston znajdował jeszcze takich obrońców, jak Duhamel, Rouelle, Black, Priestley, Cavendish i wielu innych. Pomimo, że nadawali oni zbyt wielką wagę hypotezie Stahla, przyczynili się wielce swemi badaniami do wywalczenia chemii niezależnego wśród innych nauk stanowiska; dotychczas bowiem uważano chemię jako naukę pomocniczą, np. w medycynie wszelkie sprawy patologiczne i fizyologiczne gruntowano wyłącznie na podstawach chemicznych. Kierunek ten, t. zw. jatrochemiczny, jako zbyt jednostronny, bywał zgubny dla organizmów ludzkich przez nadużywanie w leczeniu środków chemicznych, a przedewszystkiem opium, soli rtęciowych i antymonowych. Z wyjątkiem Włoch i Hiszpanii, gdzie jatrochemiczna metoda leczenia nie mogła znaleźć wielu zwolenników, hołdowano jej we Francy i, Anglii, a szczególniej w Niemczech, gdzie przetrwała najdłużej. Otóż holender Boerhaave, żarliwy stronnik Stahla, z zawodu lekarz, zerwał otwarcie z jatrochemią, zaznaczając potrzebę uznania chemii za naukę samodzielną. Inny znów flogistyk, Wilhelm Bouelle (1703 † 1770), nauczyciel Lavoisiera i Prousta, był świetnym eksperymentatorem, a jego badania nad solami doprowadziły do pierwszej trafnej definicyi tych związków, stanowiąc trwałą podstawę do dalszych studyów w tym kierunku. Black (1728 † 1799) badał związki dwutlenku węgla, a Józef Priestley (1733 † 1804) ze względu na ilość oraz doniosłość swych odkryć jest zaliczany do rzędu najznakomitszych chemików końca XVIII stulecia. Priestley (d. 1 sierpnia 1774 r.) przez ogrzewanie tlenniku rtęci w zamkniętem naczyniu otrzymał tlen, nazwany przezeń powietrzem odflogistonowanem, i zbadał jego główniejsze własności. Oprócz tego badał gazy: wodór, chlorowodór, tlenek i dwutlenek węgla, amoniak, tlenek i tlennik azotu oraz wiele innych. Do rzędu badaczy na przełomie wieków zaliczyć należy lorda Henryka Cavendish a, odkrywcę prawdziwego składu wody i powietrza, autora wielu prac, na których później opierali swe wnioski przeciwnicy teoryi Stahla, a mimo to nieugiętego zwolennika teoryi flogistycznej. Cavendish uznawał wodór za czysty flogiston i nie chciał od swego twierdzenia odstąpić pomimo danych liczebnych, jakie wykazywał Lavoisier na zasadzie ważenia ciał.

Przez wzgląd na licznych i poważnych rzeczników teoryi flogistycznej, posiadającej niejakie cechy systematu naukowego, łatwo zrozumieć, że zastąpienie hypotezy Stahla inną, mającą coprawda za sobą takich sprzymierzeńców, jak waga i ścisły rachunek, lecz niedość jeszcze ugruntowaną, napotkać musiało na silny i trwały opór. Genialny Lavoisier zdołał pokonać te trudności przez gruntowne badanie zjawisk zasadniczych, wyśledzenie ostatecznej ich przyczyny, a jego umysł krytyczny nie przyjął na wiarę uznawanej powszechnie teoryi fiogistycznej, lecz wprowadził nową, nieznaną dotychczas metodę badania, opartą na ścisłem ważeniu ciał, użytych do doświadczeń, i tak uzbrojony przystąpił do zbadania doktryny fiogistycznej. Przedewszystkiem Lavoisier przekonał się, że podczas palenia się ciał waga ich nie zmniejsza się, jakby należało wnioskować z hypotezy Stahla, lecz przeciwnie zwiększa się przez połączenie z tlenem powietrza; w tym celu ważył on ciała przed spaleniem i po spaleniu, przychodząc zawsze do wniosku, że po doświadczeniu waga ciał zwiększa się o tę ilość tlenu, jaka była niezbędną do palenia; dalej, spalając wodór w tlenie, Lavoisier otrzymał wodę, oznaczył stosunek wagowy części składowych, a przepuszczając parę wodną przez rozpaloną rurkę porcelanową, napełnioną opiłkami żelaznemi, przekonał się, że pod wpływem wysokiej temperatury nastąpił rozkład pary wodnej na tlen i wodór, przyczem pierwszy połączył się z żelazem, wodór zaś mógł być zebrany w cylindrze. Tym sposobem została dokonaną synteza i analiza wody.
Wiele ciał uznawanych dotychczas za proste, jak np. niektóre kwasy, Lavoisier rozłożył na części składowe, dowodząc zarazem, że inne ciała, jak metale oraz fosfor i siarkę uważać należy za pierwiastki. Badania Priestley’a, uwieńczone odkryciem tlenu, nie pozostały bez wpływu na doświadczenia Lavoisiera, który coraz bardziej zaczyna przekonywać się, że w pewnych ciałach, sprzyjających paleniu, znajduje się taż sama część składowa, co i w powietrzu, nadająca materyom, z któremi się łączy, własności kwasowe. Badania Lavoisiera dadzą się streścić w sposób następujący:
1) Podczas badań nad chemicznemi własnościami ciał, materya nie może ani zanikać, ani tworzyć się; masa ciałazłożonego równa się sumie mas części składowych i ztąd Lavoisier wyprowadził prawo niezniszczalności materyi.
2) Wbrew twierdzeniu flogistyków, cieplik jest materyą nieważką;
3) Palenie się, oddychanie, rdzewienie, zwapnianie, są zjawiskami łączenia się ciał z pewną składową częścią powietrza, zwaną tlenem, który wchodzi w skład kwasów i alkalii.
4) Ciałazłożone mogą ulegać rozkładowi na proste, zwane pierwiastkami, dla których dalszy rozkład jest już niemożliwy; pierwiastki nie mogą przemieniać się jedne w drugie.
W powyższych czterech punktach są zawarte zasadnicze twierdzenia wielkiego uczonego francuskiego, który w dziedzinie chemii zrobił więcej, aniżeli jego poprzednicy w ciągu ubiegłych stuleci. On pierwszy sprowadził chemię na właściwą drogę, podniósł ją do godności nauki niezależnej, pierwszy określił pierwiastek jako ciało, nie dające się rozłożyć, wyprowadził prawo niezniszczalności materyi i stworzył nowy zupełnie system, wyjaśniający należycie utlenianie i redukcyę oraz inne zjawiska, nieznane flogistykom.
Śmierć Lavoisiera (w 51 roku życia) wyrwała nauce wielkiego męża, który mógłby dokonać wielu jeszcze odkryć naukowych niepośledniej wagi; skutkiem zawieruchy politycznej, gnębiącej wówczas Francyę, Lavoisier padł ofiarą zawiści Marata i oddał głowę pod nóż gilotyny d. 8 maja 1794 r.
Lavoisier rozpoczął w chemii nową erę, wskazując drogi, któremi kroczyć zaczęła odrodzona wiedza w ciągu pierwszej połowy XIX stulecia. Jego badania stworzyły trwałe podłoże, na którem mogła rozwijać się chemia, dały obfity materyał faktyczny. Tylko strona teoretyczna znajdowała się jeszcze w zarodku, oczekując na badaczy tej miary, jak Dalton, Avogadro, Gay-Lussac i innych.
Z początkiem nowego stulecia dorobek umysłowy na polu chemii przedstawiał znaczne bogactwo, gdyż prócz wspomnianych wyżej wyników badań Lavoisiera poznano już wiele związków nieorganicznych oraz większą część pierwiastków, rozpowszechnionych w przyrodzie. Pominąwszy te, które znano już z czasów starożytnych lub średniowiecznych (złoto, srebro, rtęć, żelazo, miedź, cynk, cyna, ołów, antymon, siarka, mangan, arsen, azot, bizmut, kobalt, wodór), zaznaczyć trzeba cały szereg pierwiastków, wykrytych w ciągu XVIII. stulecia:
Platynę przywieziono z Ameryki około 1740 r.
Nikiel odkrył Cronstedt w r. 1751.
Tlen i arsen odkrył Priestley w r. 1774.
Chlor odkrył Scheele w r. 1774.
Molibden odkrył Scheele w r. 1778.
Wolfram odkrył Scheele w r. 1780.
Tellur “Mtiller “ 1782.
Tytan “Gregor “ 1791.
Chrom “Vauquelin “ 1797.
Dołączywszy do powyższego szeregu fosfor, znany już od roku 1677, otrzymamy całkowity spis pierwiastków, odkrytych i w pewnym stopniu już zbadanych na schyłku XVIII stulecia.
W Polsce najgorliwszym krzewicielem wiadomości z zakresu chemii w końcu XVIII stulecia był ksiądz Andrzej Trzciński, który sam dokonał wielu badań, a w swych traktatach naukowych wykazał niepośledni umysł przyrodnika-filozofa, obdarzony niezwykłem zacięciem polemicznem, z jakiem bronił swych poglądów naukowych.
W owe czasy wielkiego rozgłosu nabrały badania nad kwasem Dwutlenek węglanym czyli dwutlenkiem węgla. Uczeń Paracelsa, von Helmont, otrzymał po raz pierwszy (w początkach w. XVII) ten gaz jako ciało samoistne, a w r. 1744 Boyle dowiódł, że z ciał stałych można otrzymywać ten „płyn sprężysty“ (czyli „powietrze stałe“), który tem różnił się od powietrza zwykłego, że nie podtrzymywał życia organicznego, a nadto był „mocnem lekarstwem przeciw poczynającemu się gniciu“. Badania Halesa i Cavendisha wykazały, że gaz powyższy znajduje się w marmurze, a wprowadzony do wody wapiennej strąca z roztworu wapno; znajdując się zaś w zwiększonej ilości, „powietrze stałe w posiada zdolność powtórnego rozpuszczania wapna oraz innych ciał mineralnych, znajdujących się w wodzie. Odtąd zaczęto badać pilnie dwutlenek węgla, a część tych badań przypadła w udziale Trzcińskiemu, który nazwał ten gaz „powietrzem kwaskowemu, a to dlatego, że woda, nasycona tym gazem, nabiera łagodnego kwaskowatego smaku. Istotny skład gazu został oznaczony przez Lavoisiera, który dał mu pierwszy nazwę „kwasu węglanego“ (acide carbonique).
Nasycanie wód mineralnych kwasem węglanym utworzyło odrębną gałęź w przemyśle chemicznym, mianowicie w fabrykacyi wód mineralnych. Dr. F. Struwe, aptekarz z Drezna, dokonał na początku XIX stulecia analizy wód mineralnych, zaczął fabrykować wody sztuczne i w tym celu wynalazł specyalne aparaty do nasycania wody dwutlenkiem węgla. Wcześniej jeszcze nad budową aparatów do nasycania wody gazem pracowali: znany nam już badacz angielski Priestley oraz Trzciński.
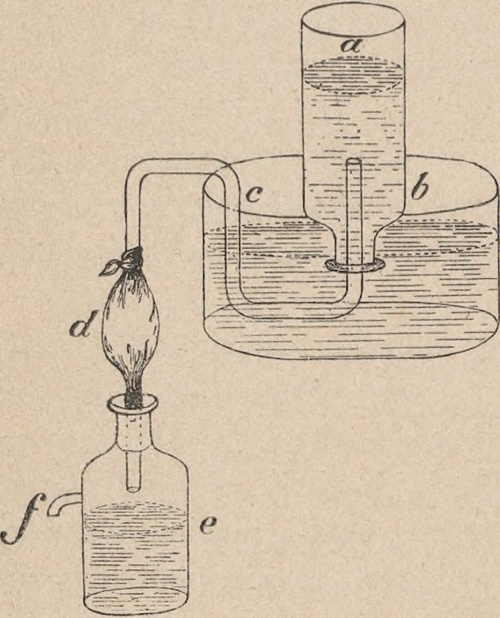
Aparat Priestley’a do nasycania wody kwasem wręglanym składał się z naczynia f, w którem wytwarzał się kwas węglany, pęcherza d oraz naczynia a z wodą; w naczyniu f znajduje się kreda i woda, do której należy dolać nieco kwasu siarczanego; otrzymany gaz można wtłoczyć zapomocą rurki do naczynia a, napełnionego wodą i odwróconego dnem do góry, przez ściskanie pęcherza d, który napełnia się wciąż kwasem węglanym, wychodzącym z naczynia f, gdzie odbywa się reakcya. Wodę żelazistą otrzymywano przez dodanie w niewielkiej ilości roztworu chlorku żelazowego.
Trzciński udoskonalił aparat Priestley’a przez usunięcie pęcherza i przystosowanie aparatu do otrzymywania „wody kwaskowej" odrazu w większej ilości, a wprowadzając do środka mieszadło wachlarzowe, obracane zapomocą korby, zbliżył się w swym pomyśle do saturatora, zbudowanego później przez dr. F. Struwego. Dodać należy, że Trzciński pierwszy zrozumiał dokładnie sposób przyrządzania sztucznych wód mineralnych i wykazał ich wyższość nad naturalnemi:
„Z tych szczęśliwych usiłowań dociekaczów natury równie ubodzy, jak i bogaci korzystać mogą, i gdyby ten sposób naśladowania wód mineralnych był wszędy upowszechniony, jużby więcej ludzie dobrze się mający nie porzucali domów i interesów swoich, nie oddalaliby się od własnych lekarzy, którzy lepiej będąc, niż obcy, wiadomi stanu i temperamentu ich, mieliby o nich skuteczniejsze staranie i mogliby też wody przysposabiać do natury i charakteru chorób, do wieku i temperamentu chorych?”
Oprócz tej cytaty zawierającej zdrowe rady, które nie straciły swej wagi po upływie przeszło 100 lat, zamieszczamy inną jeszcze (według pracy M. Stępowskiego „Wszechświat” 1901 No 23 i 24), z której można nabrać niejakiego pojęcia o zapatrywaniach naszego uczonego na ważną kwestyę, załatwioną przez Struwego znacznie później:
„Jeżeli zamiast wody kwaskowatej prostej, zechce kto naśladować wody bardziej składane, powinien włożyć do beczki w wodę, nim się zaprawi powietrzem kwaskowem, te materye, które doświadczenie pokazało w wodach zdrojowych. Jeźli te materye, które się do wody kładą, są rozwiązalne, jakoto sole spoinę alkali etc., wtedy uważa się, ich ile może wyniść z wodą, którą powietrze z beczki wypędza. Jeźli te materye nie są rozwiązalne, albo tylko mało, jakoto żelazo i ziemie, opadną na dno beczki, i wtedy nie należy mieć w rachunku względu na ilość materyi, ale na ilość wody pozostałej w beczce razem z powietrzem kwaskowem. W miarę zachodzącego mieszania przez mocne potrząsanie beczki wspomnione materye rozwiązane bywają przez powietrze kwaskowe. Tym sposobem otrzymują się wody mineralne kwaskowate, które wyrównywają wodom mineralnym źródłowym " .
Zapatrywania Trzcińskiego na lecznicze własności sztucznych wód mineralnych spotkały się z silnemi zarzutami ówczesnych lekarzy, które w ostry a stanowczy sposób zostały odparte.
Traktat Trzcińskiego p. t. „Nauka o napuszczaniu wody powietrzem kwaskowem" składa się z trzech części; w pierwszej autor zaznajamia czytelnika z historyą odkrycia, w drugiej opisuje doświadczenia własne, w trzeciej nakonie^ pisze o wielorakich gatunkach „powietrza" czyli gazów. Tutaj dowiadujemy się o chemicznych cechach gazów według pojęć ówczesnych. Tlen bywa tam nazywany „powietrzem szczerem", które otrzymuje się „z przedechu roślin na słońce wystawionych", a „podług pana Lavoisier składa ono tylko jedną z trzech części powietrza pospolitego"; dalej są opisane gazy następujące: wodór, amoniak, siarkowodór, chlorowodór, fluorowodór, dwutlenek siarki i in. Nie wiedząc o dwutlenku węgla, jako produkcie spalania się ciał organicznych, Trzciński uważa ten gaz za odmienny, nazywając „powietrzem zarażonem“, gdyż „często płodzi choroby i śmierć nawet samą przynosi“.
W hierarchii społecznej Trzciński zajmował wysokie stanowisko. W roku 1783 został członkiem kolegium fizycznego, do r. 1804 był profesorem fizyki w krakowskiej Szkole Głównej, a jako emeryt był do r. 1816 czynnym członkiem krakowskiego Towarzystwa Nauk. Spółcześni uczeni nie uznawali jego teoryi a mianowicie zwalczali je Jan i Wincenty Szastrowie, Franciszek Schneid oraz Jan Śniadecki. Ale wiedza polska zawdzięcza mu wiele. Położył on wielkie zasługi na polu fizycznego słownictwa polskiego a z drugiej strony zaznajamiał ówczesnych uczonych polskich z najnowsze mi odkryciami w dziedzinie chemii, przygotowując grunt do bogatej na tem polu działalności Jędrzeja Śniadeckiego.
O ile faktyczna strona chemii przedstawiała się na początku stulecia dość okazale, o tyle znów teoretyczna nie wychodziła po za obręb metafizycznych poglądów na budowę wszechświata filozozofów starożytności. Na 500 lat przed Nar. Chr. Leucyp wygłosił pierwszy pogląd, że wszelkie rodzaje materyi składają się z niezmiernie drobnych i niepodzielnych części; Demokryt (470 † 407) rozwinął pogląd Leucypa i pierwszy użył wyrazu „atom“ dla oznaczenia niepodzielnych już cząsteczek materyi. Nieco później zwolennikami tej teoryi byli Epikur i Lukrecyusz, aw czasach nowożytnych Gassendi, Leibnitz i Newton. Wszakże powszechne panowanie teoryi atomistycznej rozpoczyna się od prac Jana Daltona, który szeregiem doświadczeń dowiódł, że każdy pierwiastek składa się z nader drobnych niepodzielnych atomów, które, łącząc się z atomami innych pierwiastków, tworzą różne związki chemiczne. Za podstawę tych twierdzeń posłużyły Daltonowi odkryte przez Richtera prawo stałości stosunków; polega ono na tern, że połączenia chemiczne zachodzą między określonemi ciężarami ciał, biorących udział w zjawisku; np. wodór i tlen, łącząc się chemicznie, dają wodę, przytem 1 gram wodoru łączy się zawsze z 8 grm. tlenu, aby połączenie mogło nastąpić, a otrzymana w rezultacie woda waży 9 gramów; gdybyśmy wzięli 2 gramy wodoru i 17 grm. tlenu, to wodór połączyłby się tylko z 16 gr. tlenu, dając wodę, a1 gr. tlenu pozostałby w stanie wolnym. Prawo powyższe stosuje się i do ciał najbardziej złożonych; z 17 gr. amoniaku w połączeniu z 36,5 gr. kwasu solnego otrzymamy 53,5 gr. salmiaku; proporcye mogą być podwójne, potrójne it. d., lecz zawsze muszą być zachowane przy połączeniach chemicznych. Jeżeli pierwiastki tworzą między sobą nie jeden, lecz kilka związków, wówczas waga jednego składnika pozostaje niezmienna, podczas gdy drugiego wzrasta w dwójnasób, trójnasób i t. d., czyli w stosunku wielokrotnym do wagi pierwotnej. Najlepszym tutaj przykładem będzie połączenie azotu z tlenem dające pięć różnych związków: jednotlenku, dwutlenku, trójtlenku it. d. W pierwszym z tych tlenków na 1 część wagową azotu przypada 0,5696 cz. tlenu, w drugim – 1,1392, w trzecim – 1,7088, w czwartym – 2,2784, w piątym – 2,8480. Łatwo zauważyć, że ilości te znajdują się względem siebie w stosunku liczb całkowitych 1:2 : 3 :4 : 5, który to stosunek zachowuje się we wszystkich związkach, w których skład wchodzą. Prawa powyższe zostały wykryte drogą czysto empiryczną i wsparte tysiącami doświadczeń. Znalazły one potwierdzenie w równoczesnych prawie badaniach Prousta (1779-1807) który swą ścisłością rozumowania oraz jasnością tłomaczenia zapewnił prawu wielokrotności stosunków trwały byt w nauce. Znanym jest spór między Proustem a Bertholletem (w r. 1801); pierwszy bronił prawa wielokrotności stosunków, podczas gdy Berthollet utrzymywał, że w wypadku istnienia kilku związków dwóch pierwiastków stosunek wagowy zmienia się stopniowo. Zwycięstwo przechyliło się na stronę Prousta.
Pomimo tej porażki w sprawie na owe czasy wielce zawiłej i niejasnej, Berthollet (1748 † 1822) zajmuje w dziejach chemii stanowisko bardzo wybitne. Początkowo zwolennik teoryi flogistonowej Stohla, stal się w następstwie gorącym zwolennikiem Lavoisier’a. Największe wszakże zasługi Berthollet położył w dziedzinie chemii stosowanej do przemysłu: wykrył bielące własności podchloranów, co przyczyniło się znakomicie do rozwoju przędzalnictwa i farbiarstwa, zbadał skład i własności związków cyanowych, wybuchowe własności chloranów, wskazał na ulepszone sposoby otrzymywania amoniaku i w. in. Badania teoretyczne Bertholleta zaznaczyły się napisaniem w r. 1803 dzieła p. t. „Próba statyki chemiczneju, które nie przysporzyło nowych wawrzynów wielkiemu praktykowi.
Największym teoretykiem z zakresu chemii na początku wieku był Jan Dalton (1766 † 1844), o którym już wspominaliśmy. Nadal on podstawę naukową teoryi atomistycznej oraz zastosował ją do objaśnienia zjawisk chemicznych. Badając skład etylenu i gazu błotnego, niedostatecznie podówczas zbadanych, Dalton wykazał, że obydwa składają się tylko z węgla i wodoru, i przyjmując w nich jednakową ilość wodoru, wykrył, że gaz błotny zawiera ściśle dwa razy mniej węgla, niż etylen; badając znów tlenek i dwutlenek węgla, Dalton znalazł, że przy jednakowych ilościach węgla w drugim związku znajduje się ściśle dwa razy więcej tlenu, niż w pierwszym. Podobnież badania nad ilościowym składem wody, amoniaku i innych związków przekonały, że, przyjmując najmniejszą ilość jednego z pierwiastków, wchodzących w skład danych związków, za jedność, ilości drugiego pierwiastku wyrażać się będą liczbami całkowitemi 2, 3, 4 i t. d.
Tym sposobem, drogą stopniowych badań, mających na celu określenie składu chemicznego związków, Dalton nadał trwałą podstawę przypuszczeniom Richtera i Prousta, a nadto starał się usprawiedliwić swe wyniki praktyczne własną teoryą, któraby rzucała jasne światło na całokształt zjawisk Ludwik Józef Gay-Lussae (1778 † 1850). chemicznych. Przyznać należy, że teorya atomistyczna Daltona przetrwała blisko całe stulecie i nie znalazła się dotychczas w sprzeczności z żadnym faktem naukowym; słusznie więc można powiedzieć, że dzięki tej teoryi chemia może być uważana za naukę ścisłą.
Równocześnie prawie badania z zakresu fizyki gazów niemało przyczyniły się do bliższego zapoznania z budową materyi. Mariotte przekonał się na mocy doświadczeń, że gazy pod wpływem jednakowych ciśnień zmienia ją jednakowo swą objętość.

Gdy np. gaz ulega ciśnieniu trzykroć większemu, wtedy objętość jego zmniejsza się 3 razy w porównaniu do poprzedniej objętości. Gay-Lussac doszedł znów Gay-Lussac. (również doświadczalnie), jaki wpływ wywiera na objętość gazów temperatura: wszystkie gazy podlegają jednakowym zmianom objętości pod wpływem jednakowych zmian temperatury, t. j. przy podwyższaniu temperatury objętość wzrasta, przy obniżaniu zaś w równym stopniu zmniejsza się. Prócz tego Gay-Lussac wykazał, że przy jednakowem ciśnieniu i temperaturze gazy łącza. się ze sobą i rozkładają według prostych stosunków objętościowych, gdy dotychczas uznawano powyższe prawo wyłącznie w stosunkach Wagowych. Te zmiany identyczne, zachodzące w różnych gazach przy działaniu ciśnienia i temperatury, naprowadziły Amadeusza Avogadro (1776 † 1856) na myśl, że wszystkie gazy Avogadro. w równych objętościach zawierają jednakową ilość cząsteczek, gdyż w tym jedynie przypadku można wyjaśnić ich jednakowe zachowywanie się pod wpływem temperatury i ciśnienia. Ztąd wynika, że metr sześcienny wodoru, tlenu, azotu lub też gazów złożonych: pary wodnej, amoniaku it. p. zawiera jednakową ilość cząsteczek (nie atomów) przy temperaturze 0° i normalnem ciśnieniu. Do oznaczania ciężarów atomowych pierwiastków pozostał tylko krok jeden, albowiem, jeżeli metr sześcienny tlenu przy powyższych warunkach fizycznych waży 16, azotu 14, chloru 35,5 razy więcej, aniżeli wodór, wzięty w takiej samej objętości, to zarówno i cząsteczka dwuatomowa tych pierwiastków waży tyleż razy więcej, co wodoru.
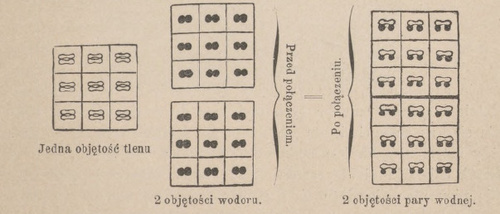
Przy związkach powstaje niekiedy zagęszczenie, mianowicie wtedy, gdy łączymy dwa pierwiastki w różnych objętościach. Dwie objętości wodoru, łącząc się z jedną objętością wody, dają dwie objętości pary wodnej; jedna objętość azotu wraz z trzema objętościami wodoru tworzy związek chemiczny, zwany amoniakiem, którego skutkiem zagęszczenia będą tylko 2 objętości. Teorya atomistyczna tłomaczy możność podobnego zagęszczenia tern, że cząsteczka wodoru, tlenu, azotu i in. składa się z dwóch atomów, które przy połączeniach chemicznych mogą się łączyć między sobą rozmaicie, jak to jest przedstawione na załączonym szemacie. W wypadku pierwszym mamy jedną objętość tlenu oraz 2 objętości wodoru; połączywszy między sobą chemicznie, otrzymamy dwie objętości pary wodnej. Jedna objętość azotu wraz z trzema objętościami wodoru da nam po połączeniu chemicznem dwie objętości gazu amoniaku, przyczem ugrupowanie atomów tlenu, wodoru i azotu nastąpi w sposób analogiczny z przedstawionym z prawej strony załączonego szematu.
Jednym z pierwszych stronników nowych podstaw teoretycznych chemii był Onufry Davy (1778 † 1829), znakomity uczony i pedagog, który potrafił w sposób dla wszystkich dostępny wyłożyć najbardziej zawiłe kwestye naukowe. Do rzędu swych uczniów zaliczał on najwybitniejsze siły, między któremi znajdowali się Berzelius i Faraday. Davy utworzył elektryczną teoryę zjawisk chemicznych, wynikająca, ze spostrzeżenia, popartego znaczną liczbą doświadczeń, że dwa ciała, znajdujące się między sobą w powinowactwie chemicznem, przy zetknięciu, elektryzują się różnoimiennie; dodatnie i ujemne ładunki tych ciał dążą do wzajemnego wyrównania się, co stanowi istotę chemicznego łączenia się tych ciał. Każdy zatem związek jest materyą elektrycznie obojętną, wszakże wskutek działania elektryczności jego części składowe odzyskują swoją pierwotną niezależność, rozkładając się przytem.
Ta elektryczna teorya zjawisk chemicznych nie ostała się; mimo to z powyższych badań nauka osiągnęła wielkie korzyści. Zapomocą prądu elektrycznego Davy otrzymał z wodanów metale alkaliczne; w roku 1807 rozłożono tym sposobem potaż gryzący, następnie sodę gryzącą, a odkrycie drogą elektrolityczną potażu i sodu metalicznego, w następstwie zaś magnezu, wapnia, strontu i barytu stwierdzało coraz bardziej słuszność Lavoisier’owskich podstaw chemii.
Drugą, niezmiernie ważną stroną w dziedzinie badań chemicznych Davy’ego było wykrycie kwasów beztlenowych, tembardziej zasługujące na uwagę, że sprzeciwiało się ówczesnym poglądom na skład kwasów. Kwas powinien zawierać bezwarunkowo tlen, a więc i kwas solny uważano za związek, zawierający w sobie tlen. Jednakże Davy przekonał zapomocą licznego szeregu doświadczeń, że istnieją, prócz tlenu, inne jeszcze gazy, podtrzymujące palenie, że istnieją sole, a zatem i kwasy, nie zawierające tlenu.
Przedewszystkiem poddawanie chloru działaniu silnego prądu, któremu nie oparły się alkalia, wykazało, że chlor jest pierwiastkiem; następnie Davy spalił sod w atmosferze chloru, a otrzymana ztąd sól kuchenna przekonała o istnieniu soli oraz kwasów, nie zawierających tlenu.
Z szeregu innych badaczy, zajmujących się przeważnie badaniem teoretycznej strony zjawisk chemicznych, trwałemi głoskami zapisali swe imiona na kartach nauki: Dulong, Petit i Berzelius.
W r. 1819 Dulong i Petit wykryli zależność, istniejącą między ciepłem właściwem pierwiastków a ich ciężarami atoniowcini, mianowicie, że im ciepłowłaściwe danego pierwiastku jest większe, tem ciężar atomowy jest mniejszy, czyli że iloczyn tych dwóch wielkości jest stały, wynoszący około 6,3. Na tej zasadzie można z łatwością określić w przybliżeniu ciężar atomowy nowego pierwiastku, znając jego ciepło właściwe, oznaczone znanemi metodami fizycznemi, co ułatwiało niezmiernie pracę chemików, odkrywających w pierwszej połowie XIX stulecia znaczną ilość nieznanych pierwiastków. Świeżo powstała teorya atomistyczna pobudziła do badań nad istotą powinowactwa chemicznego najpotężniejsze umysły. Ubocznym rezultatem tych badań było wykrycie nowych pierwiastków, chociaż to nie było głównym celem chemików, gdyż, wbrew ogólnemu mniemaniu, podobne odkrycia naukowe nie przysparzają chemikom nowych wieńców do ich sławy. Jeden z najwybitniejszych chemików omawianej doby, Jan Jakób Berzelius (1779 † 1848), Szwed z pochodzenia, wykrył znaczną ilość pierwiastków: selen, tor, cer, stront, krzem i in. Wszakże sławę swą Berzelius utrwalił przez badania nad wpływem elektryczności na związki chemiczne, rozbiory ciał organicznych, przyczem wykazał, że w związkach organicznych podobnie jak i w mineralnych, pierwiastki łączą się w prostych stosunkach swych ciężarów atomowych. Wpływ Berzeliusa na stan chemii był tak znaczny, że pozostały ślady jego badań prawie na każdym odłamie nowej nauki; na stronie zewnętrznej chemii wpływ ten zaznaczył się w utworzeniu symbolistyki chemicznej, którą stale posiłkujemy się, zamieszczając w jednym zwięzłym wzorze chemicznym to, co wymagałoby długich opisów i określeń.
W ciągu pierwszych lat trzydziestu odkryto między innemi następujące pierwiastki: tor, sod, potas, wapień, brom, jod, lityn, krzem, glin (aluminium), kadm, mangan. Znalazły one zastosowanie w technice i medycynie.

Kadmu np. zaczęto używać z powodu jego łatwej topliwości do wyrobu stereotypów w drukarniach, w połączeniu z siarką do wyrobu farb malarskich, a inne połączenia kadmu znalazły zastosowanie w medycynie, podobnie jak i lityn (odkryty w r. 1817), który jest ważną składową częścią wód karłsbadzkich, maryenbadzkich i w. in., a usuwa szkodliwe kwasy moczowe-przyczynę podagry i kamieni żółciowych. Odkryto również niezmiernie ważne pierwiastki: brom i aluminium (glin). Pierwszy z nich, posiadający własności dezynfekcyjne, ma zastosowanie w medycynie (bromek potasu), a w związku ze srebrem i potasem bywa używany do wyrobu emulsyi na kliszach fotograficznych. Odkrywcą glinu był Wohler, znany w chemii jako twórca chemii związków węgla, czyli t. zw. chemii organicznej.
W tymże okresie czasu dokonano w zakresie chemii technicznej ważnych wynalazków, gdyż zaczęto wyrabiać cement, ultramarynę, ocet, anilinę, stearynę, chininę, aldehyd. Profesor Gmelin zapoznał po raz pierwszy ogół z ultramaryną. Dotychczas używano jako niebieską farbę lapis lazuri. Z powodu niezwykle wysokiej ceny tego minerału ogłoszono w Paryżu w r. 1824 konkurs na wynalezienie sposobu sztucznego otrzymywania tej farby z nagrodą 20.000 franków, którą zdobył Guimet z Tuluzy. Jednocześnie prof. Gmelin ogłosił swój wynalazek, różniący się od nagrodzonego trwałością oraz pięknością barwy. Pierwszy wyrób na szerszą skalę był dokonywany w r. 1829 w fabryce porcelany, przyczem wyrabiano ultramarynę barwy niebieskiej, później dopiero nauczono się wyrabiać różnych barw i odcieni. W praktyce ultramaryna jest używana nietylko przy praniu bielizny, lecz również w cukrowniach, papierniach, litografiach, drukarniach, zarówno jak w malarstwie. Wykrycie nowego sposobu szybkiej fabrykacyi octu (r. 1823) miało ważne znaczenie praktyczne ze względu na wielkie zapotrzebowanie tego produktu. Pomimo, że ocet był znany z czasów starożytnych, gdyż znajduje się o nim wzmianka w Starym Testamencie, wszakże wyrób jego z wina był nazbyt drogi, a pod względem czystości przedstawiał wiele do życzenia. Znacznego ulepszenia w fabrykacyi octu dokonali alchemicy, u których ocet odgrywał znaczną rolę; wszakże fabrykacya odbywała się powolnie, około 14 dni. Nowy sposób otrzymywania octu polega na przepuszczaniu cieczy, zawierających drobny procent alkoholu, przez beczki, napełnione wiórami bukowemi, przyczem obecność grzybka (mycoderma aceti) ułatwia fermentacyę i powoduje szybki wyrób octu. Niemniej ważnego wynalazku dokonał w r. 1826 Saksończyk Unferdorben, który przy dystylacyi indyga otrzymał ciecz oleistą, którą nazwał krystaliną. Przez długie lata krystalina pędziła skromny żywot, zaledwie ją można było znaleźć w większych laboratoryach; dopiero w r.1843 Hofmann przekona! się, że jest ona identyczną z ciałem, otrzymywanem z węgla kamiennego – aniliną. Tym sposobem dzieje fabrykacyi farb anilinowych – który ch obecnie w samych Niemczech wyrabiają na sumę 65 milionów marek rocznie, i którym całe miasta zawdzięczają swe powstanie i egzystencyę – sięgają pierwszej ćwierci XIX stulecia.
Dociekania słynnego francuskiego che mika Glievreul’a (1786 † 1889) nad tłuszczami doprowadziły do udoskonalonej fabrykacyi mydła. Chevreul w ciągu swego długiego życia badał wszelkie tłuszcze i pierwszy zaczął wyrabiać stearynę, olej, margarynę.

Do rzędu środków leczniczych zaliczyć należy chininę, wynalezioną przez Caventona i Pelletiera (w r.1820) oraz aldehyd, czyli odwodniony alkohol, służący do dezynfekcyi. Przy wyrobie mydeł i perfum aldehyd bywa używany dla nadania delikatnego zapachu.
Niezwykły rozwój chemii w czasie bardzo krótkim – gdyż najważniejsze odkrycia w zakresie teoryi, zarówno jak i wynalazki w dziedzinie chemii stosowanej zostały zapoczątkowane za Lavoisier’a – świadczy, że uczeni natrafili na ślad, po którym dojść mogli do wykrycia teoryi budowy materyi, do czego dążyli oddawna, a bezskutecznie; nieobliczone zaś korzyści, jakie wypływały z zastosowania nowej wiedzy do potrzeb życiowych, stworzyły w krótkim czasie gałąź chemii technicznej, rozwijającej się z niesłychaną szybkością. Na widnokręgu naukowym dostrzeżono nowy, mimo to już wartki prąd, któremu hołdować zaczęli uczeni wszystkich krajów cywilizowanych; potężniał on coraz bardziej, wciągając liczny zastęp ludzi, którzy, jeśli nie szukali tam pereł prawdy, to zadawalali się materyalnemi korzyściami, jakie dawały zastosowania praktyczne chemii. Prąd ten przepływał zdała od Polski, gdyż z powodu przejść politycznych nie było mężów nauki, którzyby światłem swego geniuszu przyświecali europejskiej cywilizacyi. Nie brakło natomiast takich, którzyby byli zdolni przenieść na swojski grunt najważniejsze owoce badań naukowych i wzbudzić głębokie zamiłowanie do ścisłych dociekań. Pod tym względem najlepiej pojął swe zadanie i świetnie je przeprowadził Jędrzej Śniadecki, uczony sławy europejskiej, aw Polsce jedyny badacz najświeższych prądów naukowych w zakresie chemii.
Odbywszy studya medyczne w Krakowie, Jędrzej Śniadecki udał się do Wiednia, następnie do Pawii, słynącej na całe Włochy doborem sił profesorskich. Mistrzami Śniadeckiego byli tam między innemi Volta i Galvani, których doświadczenia fizyczne niezmiernie zajmowały cały ówczesny świat naukowy. Zwiedziwszy następnie ważniejsze miejscowości Niemiec, Francyi, Szwajcaryi, Belgii, udał się do Anglii, studyując wszędzie medycynę. Po powrocie do kraju Śniadecki zaczął z zapałem krzewić wiedzę, zajmując się więcej chemią, niż medycyną, wykładając w Akademii wileńskiej chemię i farmacyę. Nowe poglądy, podnoszące chemię na niebywałą dotychczas wysokość, niezrównany zapał do nauki, dar krasomówczy-wszystko to sprawiło – że wykłady Śniadeckiego ściągały mnóstwo słuchaczów, nietylko z liczby uczniów Akademii, lecz i osób postronnych. Od czasu wstąpienia na katedrę, Śniadecki nosił się z myślą ułożenia dziełka, któreby zaznajamiało z zasadami chemii i było podręcznikiem dla młodych adeptów. Rzecz to była niezmiernie trudna zarówno ze względu na ilość spornych kwestyi, które zostały znacznie później wyświetlone, jak i na zupełny brak słownictwa naukowego, lecz gruntowna znajomość współczesnego stanu wiedzy, zarówno jak ijęzyków obcych, dały możność Śniadeckiemu do napisania „Początków chemii”, które były wydane w Wilnie w r. 1800. Była to pierwsza oryginalna książka w języku polskim, traktująca o chemii, a zarazem jedyny wyborny przewodnik dla młodzieży. Wydanie drugie „Początków chemii” (1807 r.) zawierało nowe zdobycze zrobione na tem polu w ciągu ostatnich kilku lat; między innemi po raz pierwszy została tam wyjaśniona różnica między związkami organicznemi a mineralnemi. Trzecie wydanie, z roku 1817, zawiera opis użycia stosu Volty do rozkładu ciał, rezultaty badań tą drogą przeprowadzonych, teoryę Daltona stosunków chemicznych, oraz niektóre sprostowania, będące skutkiem wykrycia chloru jako ciała, nie podlegającego rozłożeniu na pierwiastki składowe.

W tymże czasie powstał spór pomiędzy Śniadeckim a lir. Aleksandrem Chodkiewiczem w kwestyi polskiego słownictwa chemicznego. W przedmowie do ostatniego wydania swych „Początkówu Śniadecki powstawał na różnych nowatorów, którzy rozsiewali, szczególniej po pismach peryodycznyeh, nowe terminy naukowe, najczęściej niezgodne z duchem języka. Chodkiewicz, wziąwszy te uwagi do siebie, starał się odeprzeć uczynione sobie zarzuty na początku trzeciego tomu swej „Chemii”. Z tej walki Śniadecki wyszedł zwycięsko, i jego słownictwo chemiczne polskie z nieznacznemi zmianami otrzymało prawo obywatelstwa; i nic dziwnego, gdyż Chodkiewicz, wzorując się na nomenklaturze francuskiej, nadawał dla określenia kwasów i podkwasów odmienne zakończenia, niezgodne z brzmieniem polskiego języka, podczas gdy Śniadecki zwracał główną uwagę na to, aby nowe wyrazy naukowe były zgodne z duchem języka. Chodkiewicz używał np. terminów: kwas siarkowy, solowy, winowy, prasowy, lluszpatowy, gdy Śniadecki pisał: kwas siarczany, solny, winny, pruski, fluorowy i t. p.

Cztery ogniska wiedzy, które na początku XIX w. rzucały światło nauki na cały kraj: Wilno, Kraków, Lwów i Warszawa, szczyciły się wielu poważnymi badaczami, chociaż nazwiska ich nie były znane zagranicą z prac samodzielnych. W Wilnie prócz Śniadeckiego wykładał chemię i farmacyę Jan Wolfgang (1775 † 1859), który założył pierwsze pismo farmaceutyczne p. t. „Pamiętnik farmaceutyczny Wileński”. W Krakowie zajmował się chemią między innymi Józef Sawiczewski, profesor farmacyi w Uniwersytecie Jagiellońskim. W r. 1810 założył on w Krakowie fabrykę cukru z krochmalu, wyrabiał różne przetwory chemiczne, między innemi chininę. Wśród licznych jego dzieł naukowych na uwagę zasługuje „Chemia lekarska”, której zaledwie pierwszy tom zdołał wykończyć. We Lwowie Teodor Torosiewicz dokonał rozbioru galicyjskich wód mineralnych i ogłosił wiele cennych prac (przeszło 100) z zakresu chemii, które zjednały mu powszechne uznanie. W Warszawie wykładali w Szkole Lekarskiej (która w r. 1818 została włączona do Uniwersytetu Aleksandryjskiego) między innymi dwaj cenieni chemicy: Celiński i Kitajewski. Józef Jan Celiński wykładał chemię i farmacyę, a w r. 1811 wydał dzieło dwutomowe „Wykład farmacyi”, pierwsze w języku polskim, dotyczące farmacyi. Z pośród innych prac na wyróżnienie zasługuje „Rozbiór wód nałęczowskich”. Kitajewski wykładał również w Uniwersytecie, przyczem dokonał analiz kilku krajowych wód mineralnych. Chemicy w dziejach chemii i farmacyi w Polsce położyli wielkie zasługi, jako niestrudzeni pracownicy i pedagogowie; im też w znacznej mierze przypada w udziale zasługa wykształcenia pokoleń przyrodników, którzy stali się chlubą naszego piśmiennictwa naukowego.